[拼音]:nengliang shouheng
[外文]:conservation of energy
能量既不能被创造,也不能被消灭。能量守衡是物质运动的普遍规律之一。物质运动有各种不同的形式,如机械运动、热、光、电、磁现象和化学变化等,它们之间能相互转化。在转化前后,作为物质运动度量的能量,其总和不变。当涉及高能量(如原子能)的变化问题时,按质能关系式E=mc2(式中E为能量;m为质量;c为光速)产生相应的质量变化。但是在化工生产过程中,一般不出现象核反应那样的高能量变化,质量变化可以忽略。
研究沿革
能量守恒的概念,在力学领域内早已为物理学家所证明。例如物体从高处自由落下时,物体的部分位能转化成动能,因此位能逐渐减小,动能逐渐增大,但在同一瞬间,动能与位能的总和不变。然而,这个守恒概念引伸到热能,则经历了二三百年之久。对于热能,在历史上有过种种错误的认识。从18世纪到19世纪中叶,自然科学界长期被热质论所统治着。这种片面的理论认为物质中存在着一种流体,称为热质。将温度差所引起的传热,视为热质从高温物体流向低温物体;而摩擦生热则认为是热质释放的结果。这个理论与许多实验事实相矛盾。1798年朗福德研制炮筒,观察到产生的热量与钻磨掉的金属屑的量不成比例,而且,如果用钝钻头继续进行钻磨,放出的热量几乎是无限的,这说明热质不可能是一种物质。以后又经过H.戴维、J.R.迈尔、H.亥姆霍兹等的工作,特别是1840~1848年间J.P.焦耳所进行的热功当量实验,人们逐步认识到热质并不存在。热的传递或转化,与机械功及电功等的传递或转化一样,也是一种能量的传递或转化,而在传递或转化时,总能量恒定不变。这样,能量守恒就在普遍的基础上被确认。
化工应用
根据能量守恒法则,可以建立能量衡算,它在科学技术领域中应用甚广,在化工中尤为重要。
系统与环境间的能量守恒
在化工生产过程中,系统与环境间有着能量的传递。由于温度差而传递的能量称为“热量”,符号用Q,并规定系统吸热为正值,放热为负值。在除温度差以外的其他推动力的影响下所传递的能量则称为“功”,符号用D,并规定系统对环境做功为正值,得功为负值。例如,由于系统与环境之间存在压力差,使系统体积膨胀而对环境做体积功,其值为正;反之,若使系统体积收缩,则所得的体积功为负值。又如由于系统产生的电动势而发生的电流对环境做电功,为正值;系统接受外电压所做电功则为负值。对于与环境没有物质交换的封闭系统中进行的过程,按照能量守恒,可得以下关系:
U1+Q=U2+W
或
ΔU=U2-U1=Q-W (1)
式中U为内能,它是除了整个系统的动能与位能以外,系统内部一切形式能量的总和;U1与U2分别为初态和终态时的内能。式(1)就是热力学第一定律的表达式,它揭示出过程的有关能量项目之间的关系。例如,气体在膨胀过程中与外界环境间的热交换量是难以用实验测定的,而从式Q=ΔU+D 可以较容易地求出。对于化工生产中常见的压力恒定的恒压过程,由式(1)可导得:
ΔH=H2-H1=Q (2)
式中H为焓,它是内能以及压力p与体积V的乘积之和,即H=U+pV。由式(2)可见,恒压过程的热交换量,只决定于终态与初态的焓差,与实际经历的途径无关。例如碳经过氧化变为二氧化碳,可以是一步氧化,也可先氧化为一氧化碳再进一步氧化为二氧化碳。这些反应表示如下:
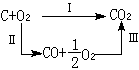
根据式(2)可得QpⅠ=QpⅡ+QpⅢ,它使我们可以用易于测定的QpⅠ和QpⅢ,求得难以测定的碳被氧化为一氧化碳所放的热QpⅡ。式(2)是封闭系统恒压过程能量衡算的基本公式。
连续流动中的能量守恒
在化工生产过程中,物料还经常在连续流动的情况下操作,例如连续蒸馏、连续反应过程、流体输送、换热等。并且在许多化工过程和设备中,不涉及除体积功以外的其他功。如果在物料连续流动的流速较慢、动能可忽略不计以及位能的变化也不大的情况下进行,则根据能量守恒法则,可得下列关系:
U1+p1V1+Q=U2+p2V2+ΔE (3)
式中U1与U2分别为流入和流出物料的内能;p1与p2分别为在物料流入处和流出处的压力;V1与V2分别为流入和流出物料的体积;ΔE是设备中能量的积累,能量增加时,ΔE为正值,减少时则为负值。如果是定态流动过程,系统中没有物质和能量的积累,则ΔE=0,于是:
U1+p1V1+Q=U2+p2V2
或
ΔH=H2-H1=Q (4)
式中H1与H2分别为流入和流出物料的焓。式(4)是定态流动过程热量衡算的基本公式。
由于符合式(2)与式(4)条件的化工过程和设备很普遍,所以根据此两式进行的热量衡算在化工生产和设计计算中应用广泛。