[拼音]:fenzi jiegou
[外文]:molecular structure
关于分子中的原子(或原子团)的键合方式和空间排列的学说。原子由于其间电的作用而构成分子,这种电结合叫做化学键合。化学键合方式虽然可以理想地分成离子键、共价键、金属键等几类,但实际情况却是这些理想的极限情况的混合。
离子键最简单的键合类型。在这种类型中,当电离能很小的活泼金属原子与电子亲合能很大的活泼非金属原子互相接近时,前者失去电子而成为正离子,后者获得电子而成为负离子。正负离子之间由于库仑引力而互相吸引,当它们充分接近时,离子的电子云之间、原子核之间相互排斥,当接近到某一距离时,吸引力和排斥力达到暂时平衡,整个体系的能量会降低到最低点而形成稳定的离子键。
离子键化合物通常都以晶体形式存在,岩盐就是典型的离子型晶体,晶体中不存在单个的分子(只有NaCl蒸气分子是离子键分子)。因为离子键没有方向性和饱和性,只要空间条件许可,离子可以从不同方向同时吸引几个带相反电荷的离子,如钠离子周围有 6个氯离子,氯离子周围有6个钠离子,正负离子在空间以相同的规则的排列方式组成晶体,整个晶体是电中性的。可见NaCl这个式子只称作化学式而不应称作分子式(见晶体的键合)。
离子键的强弱可用离子晶体的“点阵能”来衡量,点阵能是指把离子型晶体裂解成气态的正负离子所需的能量。所需能量越多,点阵能就越大,离子键也越强。点阵能大小与离子键化合物的化学性质和物理性质有密切的关系。对于相同缱佣酝牙胍桓鲈樱硪桓鲈铀烙惺保垂沙晌胱蛹4送猓梢桓鲈犹峁┮欢缘缱樱┝礁鲈庸灿械模虺莆布叟浼?BR> 近代理论阐明了共价键的本质。共价键是由于自旋相反的两个电子的原子的核外电子云发生重叠,使两个核之间出现一个电子云密度大的区域形成的。这样,整个体系能量降低而形成稳固的化学键。在形成共价键时,一般总是使原子轨道尽量重叠,这就使共价键具有“方向性”。
根据成键方式不同,共价键可分为σ键和π键两种。两核间连线称为键轴。σ 键是指轨道沿键轴方向以“头碰头”的方式发生重叠的键, 如s-s电子云重叠(氢分子中的键)、px-s电子云重叠(氯化氢分子中的键)和px-px电子云重叠(卤素单质分子中的键),s、px等符号分别表示电子所处的状态(见图)。π 键是指轨道以“肩并肩”的方向发生重叠形成的键即 p电子云侧面相互重叠(见图),通常π 键的重叠程度小于σ键,而且π键电子能量较高,易活动,是化学反应的积极参与者。
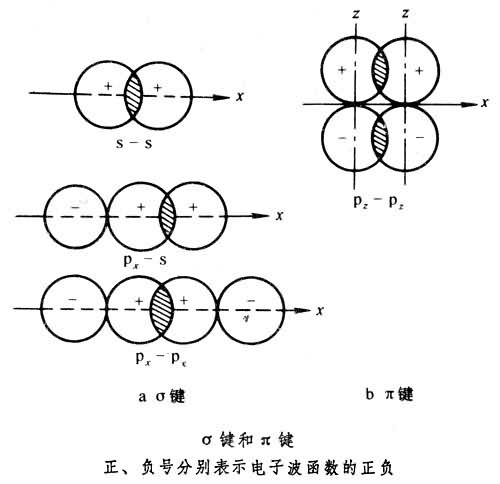
单键一般都是σ键,双键或三键中有一个是σ键,其他的是π键,由于π键电子能量较高,所以双键和三键化合 物比较活泼。
除了上述的两个原子之间形成的双原子共价键外,还有多原子共价键,即更多的原子共有一些电子。
上面的共价键理论就是“电子配对法”。原子在未化合前含有自旋相反的未成对电子,组成“电子对”,每一对电子的耦合就形成一个共价键,所以电子配对法也叫做价键法。这种理论认为,形成化学键的电子只处在以此化学键相连的两个原子之间的区域内。另一种理论是“分子轨道法”,它认为形成化学键的电子应在遍布整个分子的区域内运动,构成整体的分子,这种理论发展较晚,它可以很好地解释电子配对法所不能解释的问题,如氧的顺磁性、苯分子的特性等问题。
金属键金属原子间依靠运动自由电子相互结合的键。不论金属和合金在其晶体或熔融体中,由金属原子中脱落出来的价电子在金属原子和离子之间自由地转移和流动,而使金属原子及离子连接在一起,形成了金属键。
自由电子的存在和晶体的密堆积结构类型的离子键化合物,正负离子的半径越小,离子的电荷越多,点阵能就越高,说明离子键合越牢固,因此这种晶体也就具有较高的硬度、熔点和沸点。如MgO比NaCl晶体具有较高的硬度和熔点,MgO可作为耐火材料和磨料。熔融态离子键化合物能导电。离子键化合物也易熔于极性分子“水”中而成为电解质溶液。单电荷离子的碱金属盐、卤化物等比多电荷离子化合物如碱土金属盐、碳酸盐、硅酸盐等有较高的溶解度。
共价键主要是指由两个原子通过共用价电子对而产生的一种化学键,每一对共用电子对产生一个共价键。如果电子对由两个原子均衡共有,称为非极性共价键;如果电子对在一定程度上较多偏向某一原子,则称为极性共价键。由于偏向程度不同,具有不同程度的极性。当极性增强到?使金属具有共同的性质,如金属的光泽、导电性、导热性和延展性等。在外电场的影响下,自由电子就沿着外加电场定向运动而形成电流。加热时由于金属原子和离子的振动加强,电子运动便受到更大的阻力,因此随着温度的升高,金属的电阻也增大了。