[拼音]:wuji huaxue
[外文]:inorganic chemistry
研究无机物质的组成、性质、结构和反应的科学。无机物质包括所有化学元素和它们的化合物,碳的大部分化合物除外。碳的化合物除较简单的如:二氧化碳、一氧化碳、二硫化碳、碳酸盐等仍属无机物质外,其余属有机物质。
过去认为无机物质即无生命的物质,如岩石、土壤、矿物、水等;而有机物质则是由有生命的动物和植物产生,如蛋白质、油脂、淀粉、纤维素、尿素等。1828年德意志化学家F.维勒从无机物氰酸铵制得尿素,从而破除了有机物只能由生命力产生的迷信,明确了这两类物质都是由化学力结合而成的。现在这两类物质是按上述组分不同而划分的。
古代无机化学知识和工艺
原始人类即能辨别自然界存在的无机物质的性质而加以利用。后来偶然发现自然物质能变化成性质不同的新物质,于是加以仿效,这就是古代化学工艺的开始。如至少在公元前6000年,中国原始人即知烧粘土制陶器,并逐渐发展为彩陶、白陶、釉陶和瓷器。公元前5000年左右,人类发现天然铜性质坚韧,用作器具不易破损。后又观察到铜矿石如孔雀石(碱式碳酸铜)与燃炽的木炭接触而被分解为氧化铜,进而被还原为金属铜,经过反复观察和试验,终于掌握以木炭还原铜矿石的炼铜技术。以后又陆续掌握炼锡、炼锌、炼镍等技术。再后又有青铜(铜锡合金)、黄铜(铜锌合金)、镍白铜(铜镍合金)、砷白铜(铜砷合金)等冶铸工艺的发展。铁的熔点高,它的冶炼发展较晚,中国在春秋战国时代即掌握了从铁矿冶铁和由铁炼钢的技术,公元前2世纪中国发现铁能与铜化合物溶液反应产生铜,这个反应成为后来生产铜的方法之一。
化合物方面,在公元前17世纪的殷商时代即知食盐(氧化钠)是调味品,苦盐(氯化镁)的味苦。公元前5世纪已有琉璃(聚硅酸盐)器皿。公元7世纪,中国即有焰硝(硝酸钾)、硫黄和木炭做成火药的记载,火药是中国的重要发明之一。
明朝宋应星在1637年刊行的《天工开物》中详细记述了中国古代手工业技术,其中有陶器、瓷器、铜及各种铜合金、钢铁、金、银、锡、铅、锌(倭铅)、硫黄、食盐、焰硝、石灰、皂矾(水合硫酸亚铁)、红矾(水合氧化铁)、黄矾(水合硫酸铁)、胡粉(碱式碳酸铅)、黄丹(一氧化铅)、铜绿(乙酸铜)、明矾(硫酸铝钾)、枯矾(无水明矾)、硼砂(十水合四硼酸钠)、硇砂(氯化铵)、砒霜(三氧化二砷)、朱砂(硫化汞)、芒硝(十水合硫酸钠)、雄黄(四硫化四砷)、雌黄(三硫化二砷)、轻粉(氯化亚汞)等无机物的生产过程。
由此可见,在化学科学建立前,人类已掌握了大量无机化学的知识和技术。
化学科学的前驱──金丹术
金丹术就是企图将丹砂(硫化汞)之类药剂变成黄金,并炼制出长生不老之丹的方术。中国金丹术始于公元前2、3世纪的秦汉时代。公元 142年中国金丹家魏伯阳所著的《周易参同契》是世界上最古的论述金丹术的书,约在 360年有葛洪著的《抱朴子》,这两本书记载了60多种无机物和它们的许多变化。约在公元8世纪,欧洲金丹术兴起,后来欧洲的金丹术逐渐演进为近代的化学科学,而中国的金丹术则未能进一步演进。
金丹家关于无机物变化的知识主要从实验中得来。他们设计制造了加热炉、反应室、蒸馏器、研磨器等实验用具。金丹家所追求的目的虽属荒诞,但所使用的操作方法和积累的感性知识,却成为化学科学的前驱。
近代无机化学的建立
最初化学所研究的多为无机物,所以近代无机化学的建立就是近代化学的创始。建立近代化学贡献最大的化学家有三人,即英国的R.玻意耳、法国的A.-L.拉瓦锡和英国的J.道尔顿。
玻意耳在物理方面发现气体体积与压力的关系,从而创立玻意耳定律。在化学方面,他进行过很多实验,如磷、氢的制备,金属在酸中的溶解以及硫、氢等物的燃烧。在他所著的《怀疑派化学家》一书中,他强调化学家不应以炼丹制药为目的,而应以研究物质本身的组成、性质和变化的本质为职责,而且研究要以实验为唯一途径。他从实验结果阐述了元素和化合物的区别,提出元素是一种不能分出其他物质的物质。这些新概念和新观点,把化学这门科学的研究引上了正确的路线,对建立近代化学作出了卓越的贡献。
拉瓦锡采用天平作为研究物质变化的重要工具,进行了硫、磷的燃烧,锡、汞等金属在空气中加热而变化的定量实验,确立了物质的燃烧是氧化作用的正确概念,推翻了盛行达百年之久的燃素说。拉瓦锡在大量定量实验的基础上。于1774年提出质量守恒定律,即在化学变化中,物质的质量不变。1789年在他所著的《化学概要》中,提出第一个化学元素分类表和新的化学命名法,并运用正确的定量观点,叙述当时的化学知识,从而奠定了近代化学的基础。由于拉瓦锡的提倡,天平开始普遍应用于化合物组成和变化的研究。
1799年法国化学家J.-L.普鲁斯特归纳化合物组成测定的结果,提出定比定律,即每个化合物各组分元素的重量皆有一定比例。结合质量守恒定律,1803年道尔顿提出原子学说,宣布一切元素都是由不能再分割、不能毁灭的称为原子的微粒所组成。同一元素的原子的性质皆相同,不同元素的则不同。并从这个学说引伸出倍比定律,即如果两种元素化合成几种不同的化合物,则在这些化合物中,与一定重量的甲元素化合的乙元素的重量必互成简单的整数比。这个推论得到定量实验结果的充分印证。原子学说建立后,化学这门科学开始宣告成立。
无机化学的系统知识和研究方法
无机化学在成立之初,其知识内容已有四类,即事实、概念、定律和学说。用感官直接观察事物所得的材料,称为事实。对于事物的具体特征加以分析、比较、综合和概括得到概念,如元素、化合物、化合、化分、氧化、还原、原子等皆是无机化学最初明确的概念。组合相应的概念以概括相同的事实则成定律,例如,不同元素化合成各种各样的化合物,总结它们的定量关系得出质量守恒、定比、倍比等定律。建立新概念以说明有关的定律,该新概念又经实验证明为正确的,即成学说。例如,原子学说可以说明当时已成立的有关元素化合重量关系的各定律。化学知识的这种派生关系表明它们之间的内在联系。定律综合事实,学说解释并贯串定律,从而把整个化学内容组织成为一个有系统的科学知识。人们认为近代化学是在道尔顿创立原子学说之后建立起来的,因为该学说把当时的化学内容进行了科学系统化。
系统的化学知识是按照科学方法进行研究的。科学方法主要分为三步:
搜集事实搜集的方法有观察和实验。实验是控制条件下的观察。化学研究特别重视实验,因为自然界的化学变化现象都很复杂,直接观察不易得到事物的本质。例如,铁生锈是常见的化学变化,若不控制发生作用的条件,如水气、氧、二氧化碳、空气中的杂质和温度等,就不易了解所起的反应和所形成的产物。无论观察或实验,所搜集的事实必须切实准确。化学实验中的各种操作,如沉淀、过滤、灼烧、称重、蒸馏、滴定、结晶、萃取等等,都是在控制条件下获得正确可靠事实知识的实验手段。正确知识的获得,既要靠熟练的技术,也要靠精密的仪器,近代化学是由天平的应用开始的。通过对每一现象的测量,并用数字表示,才算对此现象有了确切知识。
建立定律古代化学工艺和金丹术积累的化学知识虽然很多,但不能称为科学。要知识成为科学,必须将搜集到的大量事实加以分析比较,去粗取精,由此及彼地将类似的事实归纳成为定律。例如普鲁斯特注意化合物的成分,他分析了大量的、采自世界各地的、天然的和人工合成的多种化合物,经过八年的努力后发现每一种化合物的组成都是完全相同的,于是归纳这类事实,提出定比定律。
创立学说化学定律虽比事实为少,但为数仍多,而且各自分立,互不相关。化学家要求理解各定律的意义及其相互关系。道尔顿由表及里地提出物质由原子构成的概念,创立原子学说,解释了关于元素化合和化合物变化的重量关系的各个定律,并使之连贯起来,从而将化学知识按其形成的层次组织成为一门系统的科学。
周期律和元素周期表
19世纪30年代,已知的元素已达60多种,俄国化学家Д.И.门捷列夫研究了这些元素的性质,在1869年提出元素周期律:元素的性质随着元素原子量的增加呈周期性的变化。这个定律揭示了化学元素的自然系统分类。元素周期表就是根据周期律将化学元素按周期和族类排列的,周期律对于无机化学的研究、应用起了极为重要的作用。
20世纪初,发现原子序数比原子量更是元素的基本性质。现代周期律的定义是:化学元素的性质随着元素原子序数的增加呈周期性的变化。
元素的原子是由带正电荷的原子核和带负电荷的电子所构成,原子序数就是原子核所带的正电荷数,也就是原子核外的电子数。电子在原子内是分层排布的,每层有一定的容量,外层容量较内层大。不同元素的原子随着原子序数的增加,逐层依次填充电子,最外层为价电子,其数由1到8,最多不超过8。元素的化学性质主要决定于价电子数,按照周期律排列,价电子数相同的元素皆归在同一类中。自第四电子层开始,价电子层的次层电子构型有稳定和不稳定之分,因此每类又分为A和B两族,或称主族和副族,同类两族元素的化学性质大同小异。ⅠA族元素的价电子数为1,与氧化合的价即为1;ⅡA族元素的价电子数为2,氧化数为2;其他类推。B族元素的最高氧化数也随族次增加而增加,其价电子的次层电子未满,构型不稳定,价易变。通常把B族编排在一起,与主族分开,成为长式周期表。
目前已知的元素共109种,其中 94种存在于自然界,15种是人造的。代表化学元素的符号大都是拉丁文名称缩写。中文名称有些是中国自古以来就熟知的元素,如金、银、铜、铁、锡、硫、砷、磷等;有些是由外文音译的,如钠、锰、铀、氦等;也有按意新创的,如氢(轻的气)、溴(臭的水)、铂(白色的金,同时也是外文名字的译音)等。中文名称的部首为“钅”的是金属元素;部首为“石”的是非金属元素;部首为“气”的在普通情况下是气体;部首为“水”或“氵”的是液体。金属元素在周期表的左方,非金属在右方,分界线是从铍与硼到钋与砹之间的一条斜折线。已知元素中绝大多数是金属,共87种,非金属和准金属仅22种。(见彩图)

周期律对化学的发展起着重大的推动作用。根据周期律,门捷列夫曾预言当时尚未发现的元素的存在和性质。周期律还指导了对元素及其化合物性质的系统研究,成为现代物质结构理论发展的基础。系统无机化学一般就是指按周期分类对元素及其化合物的性质、结构及其反应所进行的叙述和讨论。
无机化学反应
物质发生化学变化就是起了化学反应,极大多数无机物质的反应可分为两类:酸碱反应(见酸碱理论)和氧化还原反应。
酸碱反应广义地说,酸是能接受一个或几个电子对的物质(即电子受体),碱是能给予一个或几个电子对的物质(即电子给体)。在酸碱反应中,酸接受碱给予的电子对,并与之共享,形成配位键而将二者结合起来。在表1所列的反应中,配位键以箭头表示,指向受体,黑点代表电子,直线代表共价键。这些酸碱反应有专门的名称,反应(1)称为中和作用,酸的氢离子和碱的氢氧离子给合成水,变成中性溶液。水分子中的氢原子可以接受电子对,有酸的功能;它的氧原子有两对可以给出的孤电子,有碱的功能。反应(2a)称为酸的离解作用,在这里水分子作为碱,与次氯酸(一种很弱的酸)的部分氢离子结合而使之离解,成为水合氢离子H3O+。在反应 (2b)中,水的氢离子接受电子对,作为酸;氨作为弱碱,部分氨的氮原子上的电子对与水的氢离子结合而离解出氢氧离子,称为碱的离解作用。这是平常应用较多的一种狭义酸、碱的水-离子理论。这理论认为在水溶液中,酸是能离解出H+的物质,碱是能离解出OH-的物质。

酸和碱的强度可以离解常数Ka和Kb表示:

[HA]和[BOH]代表未离解的酸和碱的浓度;[H+]、[A-]、[B+]、[OH-]代表各离子的浓度。Ka、Kb值大于1的为强酸、强碱,在1~10-7之间的为弱酸、弱碱,小于10-7的为很弱酸、很弱碱。次氯酸的Ka=2.06×10-9,属很弱酸;氨(在水溶液中为NH3·H2O) 的Kb=1.8×10-5,属弱碱。由反应(2a、2b)可见,ClOH和ClO-、H3O+和H2O、NH嬃和NH3,以及H2O和OH-都是共轭的酸和碱。各对酸、碱的关系是:酸失去H+即成共轭碱,碱得到H+即成共轭酸。共轭酸碱的离解常数有如下的关系:

式中p为负对数,即-lg。
反应(3)是水解作用。(3a)为酸水解,溶液显酸性,即Al3+是一种酸;(3b)为碱水解,溶液显碱性,即ClO-是一种碱。
反应(4)是取代作用。(4a)是酸取代,是较强的酸SO3取代H2O中较弱的酸H+;(4b)为碱取代,其中较强的碱NH3取代较弱的碱OH-。
反应(5)和(6)各为两个独立存在的分子或离子(一为酸,另一为碱)经过给予和接受电子对而共享成键,产生一个加合物,称为加合作用。反应(7)和(8)各有一个中心原子(作为酸,为电子对受体)与几个配位体(作为碱,即电子对给体)结合而成为配位化合物,称为配位作用。
广义的酸和碱的强度同与之反应的碱或酸的性质有关。反应(4b),以Ag+为酸,NH3的碱性强于OH-,所以可取代它。若以H+为酸,OH-的碱性就强于NH3约5万倍,下列反应就能进行:
NH嬃+OH-─→NH3+H2O
酸也是如此。如以NH3为标准碱,则Ag+强于H+;如以OH-为标准碱,则H+强于Ag+。由此可见,广义的酸、碱缺少统一的强度标准。
氧化-还原反应还原是物质获得电子的作用,氧化是物质失去电子的作用。用离子-电子方程式表示时,还原作用示例如下:
Cl2+2e─→2Cl- (9)
Cu2++2e─→Cu (10)
氧化作用示例如下:
Na─→Na++e (11)
Zn─→Zn2++2e (12)
式中 e代表电子。以上各式表示的皆为半反应。电子有得必有失,还原作用和氧化作用两种半反应必须联系在一起才能进行。例如,半反应(9)和(11)、(10)和(12)合并成为全反应(13)和(14):
2Na+Cl2─→2NaCl (13)
Zn+Cu2+─→Cu+Zn2+ (14)
全反应即氧化-还原反应,反应中,得电子者为氧化剂,如上例中的Cl2和Cu2+,氧化剂自身发生还原作用;失电子者为还原剂,如上例中的Na和Zn,还原剂自身发生氧化作用。氧化剂得到的电子数等于还原剂失去的电子数。
任何金属M棒插入含有它的离子Mn+的溶液中,在金属和溶液之间就产生电势差。化合物中的金属元素,由于氧化态的改变,也产生电势差。差值的大小主要取决于金属的种类、溶液的温度和离子的浓度。在25℃和离子浓度为单位浓度(严格说是活度)时,这个电势差就是标准电极电势,常以符号E°表示之。这种电势的测定是以氢电极为参比标准,与之组成电池。由电池的电压即知欲测电极的电势。标准氢电极的电势规定为零,任何金属的标准电极电势就是它与标准氢电极组成电池的电势。锌的标准电极电势是-0.763伏(表2),就是说,在锌-氢电池中,电压是0.763伏,负号表示Zn是负极,而且表示在锌-氢电池的反应中,锌的反应向与表列半反应相反的方向进行。氧化还原反应是:
Zn+2H+─→Zn2++H2
铜的标准电极电势是+0.340伏,表示铜-氢电池的电压是0.340伏,正号表示铜是正极,在电池内的氧化还原反应中,铜的反应按半反应的方向进行:

H2+Cu2+─→2H++Cu
电极电势愈负,它的还原态的还原能力愈强,氧化态的氧化能力愈弱,电极电势愈正,氧化态的氧化能力愈强,还原态的还原能力愈弱。表2的元素部分按照电势的高低依次排列,就得元素的电动序。序列上面(电势较低)的还原剂可以还原下面(电势较高)的氧化剂;下面的氧化剂可以氧化上面的还原剂。
表2 的化合物电势的高低与还原或氧化能力的关系同元素完全一样。电势较高的氧化剂可以氧化电势较低的还原剂。
溶液中反应物的浓度能影响电极电势,标准电极的反应物浓度皆为1Μ。如果浓度改变,电极电势也要改变。由表2所列半反应式可见,金属离子或氧化剂的浓度减低,有利于还原作用的反向进行,电极电势负的就更负(值增高),正的就减小,次序因而上升;氧化剂的浓度增加,效果相反。因此,改变浓度可使氧化剂(或还原剂)在电动序中的位置改变。
现代无机化学
19世纪末的一系列发现,开创了现代无机化学:1895年W.K.伦琴发现X射线;1896年H.贝可勒尔发现铀的放射性;1897年J.J.汤姆孙发现电子;1898年,M.居里和P.居里发现钋和镭的放射性。20世纪初E.卢瑟福和N.玻尔提出原子是由原子核和电子所组成的结构模型,改变了道尔顿原子学说的原子不可再分的观念。1916年W.科塞尔提出电价键理论,G.N.路易斯提出共价键理论,圆满地解释了元素的原子价和化合物的结构等问题。1924年,L.-V.德布罗意提出电子等物质微粒具有波粒二象性的理论;1926年,E.薛定谔建立微粒运动的波动方程;次年,W.H.海特勒和F.W.伦敦应用量子力学处理氢分子,证明在氢分子中的两个氢核间,电子几率密度有显著的集中,从而提出了化学键的现代观点。此后,经过几方面的工作,发展成为化学键的价键理论、分子轨道理论和配位场理论。这三个基本理论是现代无机化学的理论基础。现代物理实验方法如:X射线、中子衍射、电子衍射、磁共振、光谱、质谱、色谱等方法的应用使无机物的研究由宏观深入到微观,从而将元素及其化合物的性质和反应同结构联系起来,形成现代无机化学。现代无机化学就是应用现代物理技术及物质微观结构的观点来研究和阐述化学元素及其所有无机化合物的组成、性能、结构和反应的科学。无机化学的发展趋向主要是新型化合物的合成和应用,以及新研究领域的开辟和建立。
新型化合物是一些结构新和成键方式新的化合物,其中不少是有机金属化合物。
(1)夹心化合物 由片状配位体以大π 键(见共价键)把金属原子夹在中间所形成的配位化合物。1951年发现二茂铁,它的结构示意见图1a。

不久发现苯和铬(图1b)、环辛四烯和铀(图1c)可形成类似的稳定化合物。实际上,几乎所有的过渡元素皆可作为这类化合物的中心原子。夹合中心金属原子的配位体也不必是共轭环化合物,非共轭环如环辛二烯(图1e)和直链不饱和化合物如丙烯基(图1d),皆可形成这类化合物。两个环可平行,也可不平行,可以是大π键的多搭,也可以是σ 键的单搭(图1f);中心原子可一面与共轭环结合,另一面与一般配体如羰基配位(图1g),也可形成多核聚合物(图1h)等。
(2)穴状化合物 包括冠醚金属化合物。 属于巨环多齿配体的有机金属化合物。第一个冠醚二苯并18-冠-6是在1967年合成的:
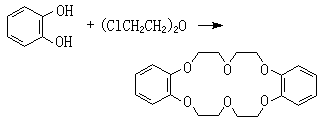
它是18原子环,其中6个为氧原子,它对碱金属离子有强的配位力。 冠醚环的大小不同时, 对金属离子的配位能力就不同。 现在已合成出有3~20个氧原子的冠醚。N、O巨环化合物可形成多环配体,例如具有双环结构的N(CH2CH2OCH2CH2OCH2CH2)3N,结构式如下。商品名称为穴合剂 222,对碱金属和碱土金属离子皆有配位能力,形成稳定度不同的穴状化合物。

(3)簇状化合物 又称原子簇金属化合物, 简称簇合物。最先合成并经充分研究的金属簇合物是 Re2Cl82-(图2a)。
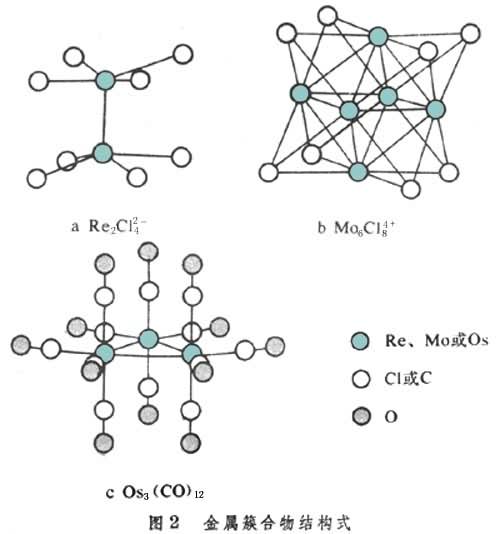
簇合物的特征是分子中存在金属键。这类化合物多为低价金属的卤化物或氧化物,以及零价金属的羰基、亚硝酰基等配体的化合物(图2b、图2c)。过渡元素中部的金属Ti~Ni、Zr~Pd和Hf~Pt容易形成簇合物。簇合物既保持细粒金属的性质,也具有单核金属配合物的性质,兼有多相催化和均相催化的作用,可成为一类活性高和选择性好的催化剂。
新兴研究领域由于各学科的深入发展和学科间的相互渗透,形成许多跨学科的新的研究领域。无机化学与其他学科结合而形成的新兴研究领域很多,例如:
(1)生物无机化学 是无机化学与生物化学结合的边缘学科。现在已知动植物生命中有30多种元素,其中19种为金属。在许多生物过程中,金属起着核心作用,如动物体中运送氧气的作用是靠血红蛋白中的铁元素,植物的光合作用是靠含有镁原子的叶绿素吸收太阳能将二氧化碳和水转变为氧气和碳水化合物。植物的固氮菌是一种酶,它能在常温常压下以水和空气中的氮为原料合成氨,这种酶是由含铁、钼和仅含铁的两种蛋白质所组成。其他重要的金属酶有:促进蛋白质中肽键断裂的羧肽酶,促进水和二氧化碳形成碳酸的碳酸酐酶,这两种酶皆含锌。现知含各种金属的酶有数百种之多,它们的功能皆和金属元素与生物体内物质的反应有关。
(2)有机金属化学 有机金属化合物是金属元素与有机物的碳原子成键的化合物。发现较早的有以下几种反应的产物:
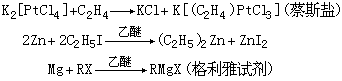
式中RX为卤代烃。一般地说,周期系的主族金属容易与碳成键;过渡金属具有d电子,除能与有机配体形成σ或π 键外,还有反馈作用,使化合物稳定。前面所提的新型化合物,如夹心化合物和簇合物,多数都是有机金属化合物。这类化合物广泛用作有机合成的试剂、化工生产的催化剂、医药、农药和特种材料等。通过对这类化合物的研究,已从理论上将无机化学和有机化学沟通了。
(3)无机固体化学 是化学和物理学结合的新兴研究领域。现代科学技术需要耐高温、耐腐蚀、耐老化、高强度、高韧性的结构材料和具有良好的光、电、声、磁、热、力等性质的功能材料。这些材料多数为无机固体物质,很多材料是非整比的化合物,常由固相反应制备。在合成中要使用高温、高压、高真空等技术。如在2500℃和200000大气压下,碳(石墨)可以转变成金刚石。无机固体化学就是研究功能材料在制备过程中的变化和控制机理,以及在晶体生长、固体腐蚀、氧化、电化学等过程中,涉及缺陷和杂质对固体中原子、电子和晶格运动的影响等物理过程的学科。
- 参考书目
- 袁翰青著:《中国化学史论文集》,三联书店,北京,1956。
- J. E. Huheey,
- Inorganic Chemistry,Principles of Structure and Reactivity, 3rd ed., Harper and International Science, Cambrige, 1983.