[拼音]:yuanzi jiegou
[外文]:atomic structure
原子由一个原子核和核周围一定数目的电子构成。核内有中子和质子。各种核的性质不同;核外电子构型决定元素的物理性质和化学性质。
电子的发现1858年德意志科学家J.H.W.盖斯勒作低压放电管试验时发现,当管内气压降到约5毫米汞柱时,通以高压电,发出辉光,不同气体发出不同颜色的辉光。1879年英国化学家W.克鲁克斯发现当气压降为0.01毫米汞柱时,不再发辉光,而在对着阴极的玻璃管中发出粒子流,后来许多实验发现:磁场、电场能偏转粒子流行进的方向,粒子流能推动克鲁克斯管中的风车,能被行进途中障碍物挡住,并在玻璃壁上留有阴影。由此证明,粒子流是一种带负电的粒子束──阴极射线。
1897年英国人J.J.汤姆孙利用该粒子束在电场和磁场中的联合偏转性能,测定了它的速度v=E/H(E为电场强度,H为磁场强度)及荷质比e/m(e为电荷,m为质量)。大量实验证实,e/m是定值,不因电极材料和管中气体的种类而变。这就表明,粒子束是由各种原子的共同成分──电子──形成的。热电子发射、光电效应也表明电子存在于一切原子之中。目前认为电子的质量是9.1095×10-31千克。
卢瑟福原子模型英国科学家E.卢瑟福1911年根据α粒子散射实验(图1),提出原子行星模型。
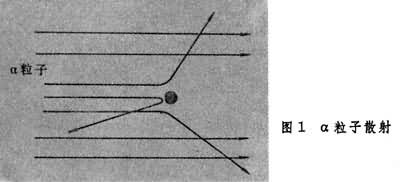
卢瑟福用α 粒子撞击厚度为 0.6微米的金箔时发现,绝大部分α 粒子都能穿透金属薄片,其运行方向与原来的差不多,少数穿过金属时有相当大的角度的偏转,还有个别被反弹回来。实验表明:原子内部有很大的空隙,被反射回来的α粒子一定是碰到了质量远大于α粒子的、带正电荷的极小微粒的结果。因为α 粒子的质量是电子的7000余倍,若两者相撞,只可能是电子被弹开,α 粒子偏离不大。通过精密实验及理论计算得知,原子核的半径为0.03皮米,核上的正电荷数为79。同年,卢瑟福在此实验基础上提出原子行星模型:原子中有个极小的核,它几乎集中了原子全部的质量,带有Z个正电荷,另有Z个电子绕核运动,就像行星绕太阳旋转一样(图2)。
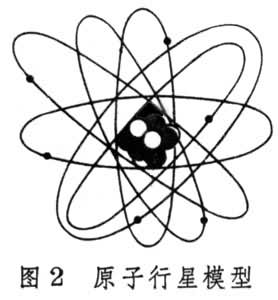
以后的大量实验证明,原子半径在100皮米左右,原子核的半径为10-2~10-3皮米,原子核的正电荷数和该元素在周期表中的原子序数一致。
玻尔理论根据原子行星模型、量子概念和光子概念来阐明氢原子光谱和原子结构的理论。由丹麦物理学家N.玻尔在1913年提出。(见玻尔理论)
量子数表征微观粒子运动状态的一些特定数字。用它可较全面地描写原子中电子空间运动的状态。(见量子数)
电子云描写电子在原子核周围各区域出现几率的名词。将这种几率分布用图象表示时,以浓淡程度表示几率的大小,其形象如同电子在原子核周围形成的云雾,故名。(见电子云)