[拼音]:fenzi ouyu
[外文]:molecular encounter
液相中分子不同于气相分子的一种特殊碰撞。描述气相中分子A和B进行化学反应的动力学特征时,首先考虑A和B之间的碰撞而形成碰撞分子对,用碰撞分子对的浓度表征其数量,反应速率与碰撞分子对所包含的能量有关。而在液相中,溶剂的存在妨碍分子直接碰撞,A和B之间须经过扩散(见扩散控制)进行接触,达到偶遇,形成偶遇对,也称扩散对,其量用偶遇对浓度来表征。在标准状况下,氮气分子的体积只占所占有空间的 0.2%,在液相中虽达50%以上,但若有溶剂,则大大降低其反应速率。
图

是用计算机计算的液体中分子在瞬时位置的一张模拟剖面“快相”。它显示出液相中分子近似于一种无规则紧密堆积,某一区间内含有不稳定的微晶,其中分子的相对取向却相当规整。在此溶液中,反应物分子处于溶剂分子“笼”的包围之中(见笼效应),分子A和B通过扩散可以偶遇。相A和B恰好是构成一个反应(如A+B─→P)所必需的反应物分子时,在一个笼中的反复碰撞称为一次偶遇,它暗示A和B陷于一个溶剂笼中,形成的偶遇对(也称扩散对)用[A—B]表示,都被溶剂分子所包围。它具有反应物的组成和近似产物的结构。因此,在相同的浓度和分子大小情况下,由于液相中分子偶遇的数目比气相中分子的碰撞数少,而偶遇对在同一笼中相互碰撞数增多,对于有些反应(如五氧化二氮的分解)而言,气相和液相中的反应速率就不相上下。
偶遇对的观点认为,液相反应要经过以下步骤:
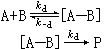
即反应物分子A和B首先通过扩散来到同一笼中,并在笼中停留一个相当“长”的有限时间,再反应生成产物 P。当然偶遇对[A—B]也可能没有发生反应而又重新分离。式中kd为扩散过程的速率常数;k-d是偶遇对分离过程的速率常数;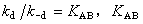 为扩散平衡常数,它与溶液中偶遇数、液体的结构和其他性质有关;kr是偶遇对发生化学反应的反应速率常数。
为扩散平衡常数,它与溶液中偶遇数、液体的结构和其他性质有关;kr是偶遇对发生化学反应的反应速率常数。