[拼音]:Hamite fangcheng
[外文]:Hammett equation
表达反应速率与反应物结构间定量关系的一个方程式。由L.P.哈米特于1937年首先提出。该方程在有机结构理论中很重要。
在芳香族化合物,特别是苯类化合物的反应中,若不含取代基的反应物的反应速率常数为k0,当引入取代基后,其反应速率常数为k,则k与k0之间有如下关系:
lgk=lgk0+σρ
这就是哈米特方程,式中σ为取代常数,其值决定于取代基团的性质和位置(如邻位、间位、对位);ρ为常数,决定于反应类型。
哈米特方程的另一种形式是描述反应平衡常数的关系,即:
lgK=lgK0+σρ
式中K0为不含取代基的反应物的平衡常数;K为含取代基的反应物的平衡常数。
规定氢的σ值为0.00,苯甲酸和取代苯甲酸的水溶液在25℃时电离反应的ρ为1。根据苯甲酸的电离常数K0和取代苯甲酸的电离常数K:

即可求得各种取代基的相对σ值:

表1列出了一部分基团的σ值。给电子基团的σ为负值,吸电子基团的σ为正值。同时,由σ数值的大小,可定量表示取代基给电子性或吸电子性的强弱。σ是各种效应的综合结果,σ的数值不仅包含了基团的诱导效应,还包含了共轭效应、空间效应等作用。
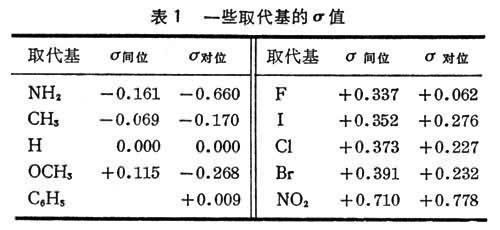
σ 值一般常用于苯和芳烃上的取代,也可作为取代基给电子性或吸电子性的一个经验参量,广泛用于各类化合物的多种反应和物理化学性能的研究。
根据已求得的σ值,可用哈米特方程求得各反应的ρ值。表2列出了部分反应的ρ值。ρ值可为<0、0、0<ρ<1、≥1等各种可能的数值。近年来,人们认为ρ 的数值与反应过渡态的荷电情况有关。当过渡态与反应物相比具有正电性时,则ρ<0;具有负电性时,则ρ>0;电性无变化时,则ρ=0。如果与ρ=1的标准反应相比,则ρ<1表明该反应在过渡态时的电荷改变比标准反应具有更强的正电性,ρ值越小,则正电性越强;ρ>1时,则过渡态之电荷改变比标准反应具有更强的负电性,ρ值越大,则负电性越强。根据ρ值可判断反应过渡态的可能状况。测定反应的ρ值,已成为研究有机反应机理的有效手段之一。
